Descrizione
Olio al CBD di origine naturale, estratto a crudo, non adulterato e non addizionato di estratti chimici, ricavato da piante di Cannabis da coltivazione biologica.
| Cannabidiolo | |
|---|---|
 |
|
 |
|
| Nome IUPAC | |
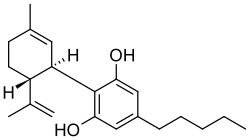
| 2-[(1 R ,6 R )-6-isopropenil-3-metilcicloes-2-en-1-il]-5-pentilbenzen-1,3-diolo | |
| Abbreviazioni | |
| CBD | |
| Nomi alternativi | |
| (–)–trans-cannabidiolo Δ2-cannabidiolo |
|
| Caratteristiche generali | |
| Formula bruta o molecolare | C21H30O2 |
| Numero CAS | |
| Numero EINECS | 689-176-3 |
| PubChem | 644019 |
| DrugBank | DBDB09061 |
| SMILES |
CCCCCC1=CC(=C(C(=C1)O)C2C=C(CCC2C(=C)C)C)O |
| Proprietà chimico-fisiche | |
| Solubilità in acqua | insolubile |
| Proprietà tossicologiche | |
| DL50 (mg/kg) | 50 mg/kg nei topi intravena |
| Indicazioni di sicurezza | |
Il cannabidiolo (CBD) è un composto chimico scoperto nella Cannabis sativa essiccata e nell’hashish nel 1940.[1][2] È uno dei 142 fitocannabinoidi identificati nelle piante di Cannabis sativa.[3]
Si trova anche nelle foglie della cannabacea filogeneticamente più vicina alla Cannabis sativa, il luppolo,[4][5] e può essere prodotto anche per sintesi chimica.
Come cannabinoide ricavato dalla Cannabis è oggetto di controversie sul suo utilizzo legale, alla luce delle diverse interpretazioni e applicazioni dei trattati internazionali di controllo delle droghe. Il CBD non ha la stessa psicoattività del THC, il principale agente psicotropo della cannabis.
La progressiva e parziale liberalizzazione della Cannabis, agli inizi del XXI secolo, ha consentito l’avvio di molte ricerche sui potenziali utilizzi farmacologici del CBD e, in alcuni paesi, la commercializzazione di prodotti caratterizzati dalla presenza del CBD. A partire dal 2017, quando l’OMS dichiarò che il CBD non era tra le sostanze controllate[6], la ricerca clinica sul CBD poteva contare su studi relativi ad ansia, cognizione, disturbi del movimento e dolore, cancro, ecc.; ma non disponeva di prove di alta qualità sufficienti a dichiarare l’efficacia del cannabidiolo per il trattamento di queste condizioni.[7][8][9] È stata invece riconosciuta da alcune autorità sanitarie l’efficacia di un farmaco a base di CBD per alcune forme rare e gravi di epilessia.[10][11]
Esistono vari tipi di CBD, la più comune è per via orale in gocce, queste vengono prescritte per pazienti che soffrono di diabete, artrite reumatoide, ansia, disturbi dell’umore, epilessia, problemi della pelle. Inoltre alcuni studi suggeriscono che sia molto utile verso soggetti dipendenti dall’eroina in quanto la CBD riesca a far diminuire il desiderio di utilizzarla sino a quando il corpo non la smaltisca.[1]
Nonostante gli studi effettuati sul corpo umano e animale non è ancora chiaro se la CBD riesca a sostenere le persone con i problemi elencati precedentemente ma sono stati provati eventuali effetti collaterali: Diarrea, Assenza di appetito, Affaticamento, Cambiamenti di umore, Insonnia e Danni al fegato.[senza fonte]
Biosintesi CBD
Il CBD è considerato un metabolita secondario della Cannabis sativa, mentre in realtà è un artefatto che si forma per decarbossilazione non enzimatica dell’acido cannabidiolico (CBDa) durante l’essiccazione.
Il percorso anabolico che porta alla formazione del CBD nella cannabis sativa è in gran parte in comune con quello del tetraidrocannabinolo (THC), il principale agente psicotropo della cannabis.
Il cannabigerolato è anche il precursore, attraverso una diversa reazione enzimatica, dell’acido tetraidrocannabinolico (THCa) da cui deriva il THC.
La decarbossilazione di CBDa e THCa viene spontaneamente accelerata per azione della luce e/o del calore.
CBDa e THCa, provenendo dallo stesso intermedio, sono complementari; pertanto nelle varietà di cannabis a basso tenore di THC il cannabidiolo è il principale cannabinoide estraibile, al contrario delle varietà ad alto tenore di THC dove il THC è il cannabinoide principale.
| Enzima | Precursore, intermedio e reazione | |
|---|---|---|
| 3,5,7-triossododecanoil-CoA sintasi | malonil-CoA | |
| ↘ | ↓ | |
| 3 malonil-CoA + esanoil-CoA + 3,5,7-triossodecanoil-CoA + 3 CO2 | ||
| ↓ | ||
| ciclasi dell’acido olivetolico | 3,5,7-triossodecanoil-CoA | |
| ↘ | ↓ | |
| 3,5,7-triossodecanoil-CoA ⇔ CoA + 2,4-diidrossi-6-pentilbenzoato | ||
| ↓ | ||
| geranil-difosfato:olivetolato geraniltransferasi | 2,4-diidrossi-6-pentilbenzoato (acido olivetolico) | |
| ↘ | ↓ | |
| Geranil difosfato + 2,4-diidrossi-6-pentilbenzoato ⇔ difosfato + cannabigerolato | ||
| ↓ | ||
| sintasi dell’acido cannabidiolico | Cannabigerolato | |
| ↘ | ↓ | |
| Cannabigerolato + O2 ⇔ Acido cannabidiolico + H2O2 | ||
| ↓ | ||
| Acido cannabidiolico | ||
| ↓ | ||
| Acido cannabidiolico ⇔ Cannabidiolo + CO2 | ||
| ↓ | ||
| Cannabidiolo |
Biochimica
Isomeri
CBD e THC sono isomeri costituzionali con la stessa formula bruta: C21H30O2.[12][13] Sono stati identificati 7 isomeri posizionali e da 30 a 60 stereoisomeri del CBD,[14][15][16][15] e lo stesso CBD è considerato in alcuni studi un isomero del THC.[13][12] Con “cannabidiolo” tipicamente ci si riferisce all’enantiomero naturale (-)-CBD mentre sull’enantiomero (+)CBD di sintesi sono stati prodotti meno studi.
Il CBD normalmente rilevato nella pianta della cannabis ha il doppio legame in posizione 2 dell’anello non benzenico. È quindi l’isomero Δ2-Cannabidiolo con i centri chirali in posizione 1 e 6.
È stato dimostrato che il (+)CBD ha una modesta affinità con i recettori CB1 e CB2, mentre il (-)CBD e il (+)-CBD inibirebbero l’idrolisi dell’anandamide e sarebbero agonisti del recettore vanilloide 1 (VR1) responsabile dell’azione della capsicina.[17]
L’isomero (+)-CBD è maggiormente attivo rispetto all’isomero (-)-CBD come agente anticonvulsivante in modelli murini.[18] Tuttavia, a oggi, non ci sono prove sostanziali per stabilire se è probabile che (+)-CBD causi effetti psicoattivi simili al THC.
Ciclizzazione

Di particolare interesse per definire l’assetto legale della sostanza è la possibile ciclizzazione del cannabidiolo.
Il CBD ciclizza a Δ8- e Δ9-THC in presenza di acidi di Lewis (ad es. trifluoruro di boro dietiletere o donatori di protoni come l’acido p-toluensolfonico); con il Δ8-THC ciclizzato da acidi forti e il Δ9-THC ciclizzato da acidi deboli.[13]
Due studi in vitro avrebbero dimostrato che il CBD si converte in THC nei succhi gastrici.[19][20] Il rateo di conversione rilevato sarebbe pari al 2,9%.[20] La conversione in vivo non è stata dimostrata e l’assunzione orale di CBD non produrrebbe gli effetti del THC.[21][22][23][24]
La ciclizzazione del CBD in THC avverrebbe anche per pirolisi ad alte temperature ma non quando viene bruciato.[25][26]
La conversione del CBD in THC o in altri cannabinoidi psicotropi è oggetto di controversia scientifica.[27]
In un ambiente fortemente basico in condizioni ossidative, anche esposto all’aria, il CBD viene prima idrossilato sull’anello aromatico e poi ossidato a idrossichinone.[28]
Se conservato a lungo in presenza di aria, si ossida a cannabinolo.
Farmacologia
A tutto il 2020 solo due farmaci contenenti cannabidiolo, entrambi della GW Pharmaceuticals, sono stati messi in commercio nell’Unione europea: l’Epidiolex, contenente 100 mg di cannabidiolo ogni millilitro di prodotto, indicato come anti-convulsivo per trattare due forme rare di epilessia,[11] e il Sativex,[29] contenente 2,7 mg di delta-9-tetraidrocannabinolo (THC) e 2,5 mg di cannabidiolo (CBD) ogni 100 μL, utilizzato come antispastico per alleviare i sintomi in pazienti adulti affetti da spasticità da moderata a grave dovuta alla sclerosi multipla che non hanno manifestato una risposta adeguata ad altri medicinali. Di entrambi il meccanismo d’azione non è stato perfettamente compreso.[30]
Di altri farmaci sono in corso sperimentazioni cliniche.
| Effetto | THC | CBD | Riferimenti |
|---|---|---|---|
| Effetti recettoriali e non recettoriali | |||
| CB1 | ++ | ± | [32][33][34] |
| CB2 | + | ± | [32][35] |
| Antinfiammatorio | + | + | [36] |
| Immunomodulante | + | + | [37] |
| Effetti sul SNC | |||
| Anticonvulsivante | + | ++ | [38] |
| Rilassante muscolare | ++ | + | [39] |
| Ansiolitico | ± | ++ | [40][41] |
| Psicotropo | ++ | ± | [42][43] |
| Antipsicotico | − | ++ | [44][45] |
| Problemi di memoria a breve termine | + | − | [34][46] |
| Distorsione della percezione del tempo | ++ | − | [47][48] |
| Antiossidante neuroprotettivo | + | ++ | [36] |
| Antiemetico | ++ | ++ | [49] |
| Sedazione | + | − | [50][51] |
| Effetti cardiovascolari | |||
| Bradicardia | − | + | [52] |
| Tachicardia | + | − | [53] |
| Ipertensione | ± | − | [54] |
| Ipotensione | ± | + | [53] |
| Appetito, gastrointestinali, metabolici | |||
| Appetito | + | − | [55] |
| Motilità gastrointestinale (rallentata) | ++ | + | [56] |
| Metabolici/diabete | – | – | [57] |
| Anticarcinogenesi | |||
| Glioma (apoptosi) | + | + | [58] |
| Cancro ai polmoni | + | ++ | [59] |
| Oftalmologico | |||
| Pressione intraoculare (ridotta) | ++ | + | [60] |
CBD e THC
Il CBD non produce gli stessi effetti psicotropi del THC, anzi se somministrato contemporaneamente ne può attenuare alcuni.
Il CBD potenzierebbe l’efficacia analgesica del THC prolungandone la durata di azione (attivando la pathway serotoninergica a livello del rafe dorsale) e al tempo stesso ne riduce gli effetti collaterali su frequenza cardiaca, respirazione e temperatura corporea.[61]
In particolare il CBD interagisce come antagonista verso i recettori GPR55, verso i recettori vanilloidi TRPV1 e TRPV2 e come agonista verso i recettori per la serotonina 5-HT1A[62][63]. Il cannabidiolo, in maniera simile al tetraidrocannabinolo e ad altri cannabinoidi e terpeni hanno interazioni dirette e indirette su una moltitudine di neurotrasmettitori, come GABA, serotonina, dopamina e glutammato.
Il cannabidiolo ha una bassa affinità con i recettori dei cannabinoidi CB1 e CB2 ma agisce come modulatore allosterico negativo di questi recettori.[64][65][66] Può potenziare alcuni degli effetti del THC aumentando la densità del recettore CB1 o attraverso un altro meccanismo relazionato al recettore CB1.[67][68] Il cannabidiolo può inoltre estendere la durata degli effetti del THC fungendo da inibitore di potenza moderata su alcune isoforme enzimatiche del citocromo P450 ossidasi, in particolare la sottocategoria degli isoenzimi CYP2C9 e CYP1A2 e CYP1A4.[69]
Farmacodinamica
Effetti serotoninergici
Il cannabidiolo può fungere inoltre da antagonista del GPR55, una proteina accoppiata al recettore G, un recettore dei cannabinoidi putativo ed è espressa nel nucleo caudato e nel putamen del cervello. È stato anche osservato agire come un agonista parziale 5-HT1A,[62] questa sua interazione può essere associata con gli effetti antidepressivi,[70][71] ansiolitici,[71][72] e neuroprotettivi[73][74] del cannabidiolo. È inoltre un modulatore allosterico positivo dei recettori μ-oppioidi e δ-oppioidi.[75] Gli effetti farmacologici del cannabidiolo sono stati inoltre attribuiti all’agonismo PPAR-γ e al rilascio di calcio intracellulare.[76]
Altri effetti
La ricerca suggerisce che il CBD può esercitare alcune delle sue azioni farmacologiche attraverso l’inibizione della Fatty Acid Amide Hydrolase (FAAH), l’enzima responsabile dell’idrolisi dell’anandamide, uno dei principali endocannabinoidi prodotti dal corpo.[76] È stato anche ipotizzato che alcuni dei metaboliti del CBD possano avere effetti che contribuiscano all’attività biologica del CBD stesso.[77]
Recentemente, il cannabidiolo è stato identificato come un nuovo agonista inverso del GPR12.[78]
Secondo una ricerca di laboratorio effettuata nel 2007 da un’équipe del California Pacific Medical Center Research Institute, il cannabidiolo potrebbe essere in grado di bloccare il gene Id-1 che provoca la diffusione delle metastasi del cancro al seno, ma anche di altre forme tumorali. Un successivo studio condotto dall’Università di Rostock, in Germania, confermerebbe proprietà simili dei cannabinoidi.
Assetto legale
La Convenzione unica sugli stupefacenti del 1961 ha inserito le sommità fiorite o fruttifere della pianta di cannabis e la resina, estratti e tinture ottenuti dalla cannabis tra gli stupefacenti sottoposti alle massime restrizioni e controlli. In applicazione del trattato internazionale i 186 paesi sottoscrittori hanno legiferato imponendo restrizioni alla produzione, commercio e utilizzo di tutte le sostanze classificate come stupefacenti. Anche il cannabidiolo estratto dalla cannabis, pur non essendo espressamente citato nelle liste delle sostanze controllate, è stato oggetto delle restrizioni legali che tra l’altro hanno prodotto ostacoli e ritardi anche alla ricerca scientifica.
La progressiva e parziale liberalizzazione nella produzione e commercializzazione della cannabis a basso tenore di THC ( < 0,2-1% a seconda della legislazione), cannabis che tra l’altro ha normalmente un alto tenore di CBD, dopo oltre 50 anni dal trattato[79][80], ha aperto le porte alla ricerca sul cannabidiolo e al suo potenziale utilizzo farmacologico. Quando nel 2017 l’OMS dichiarò che il CBD estratto dalla cannabis non era più tra le sostanze controllate[6] la sua produzione e fornitura non è stata più soggetta a severi controlli internazionali. Non essendoci più vincoli internazionali, lo status legale del cannabidiolo è diventato a totale discrezione di ogni paese, dove in molti casi non è stata promulgata nessuna norma specifica per regolamentarlo. Così a fronte di alcuni paesi dove produzione e commercio di cannabidiolo era ancora sottoposta alle leggi per il controllo delle droghe altri lo avevano liberalizzato.[81]
Il CBD può essere utilizzato nelle formulazioni cosmetiche, dove sono stati attribuiti distinti nomi INCI: CANNABIDIOL – DERIVED FROM EXTRACT OR TINCTURE OR RESIN OF CANNABIS oppure CANNABIDIOL – SYNTHETICALLY PRODUCED. La sicurezza del prodotto cosmetico con CBD è regolata dalle leggi e regolamenti nazionali o sovranazionali sul cosmetico.[82]
Il CBD non ha effetto stupefacente, per questi motivi, quando derivato dalla canapa industriale, è vendibile liberamente per le finalità previste dalla legge n. 242/2016.[83]
Unione europea
Nel 2020 la Corte di giustizia europea su un conflitto tra norme ceche e francesi ha sentenziato che: “Uno Stato membro non può vietare legalmente la commercializzazione del cannabidiolo (CBD) prodotto in un altro Stato membro quando viene estratto dalla Cannabis sativa nella sua interezza”.[84][85] Le norme che regolano produzione e utilizzo del CBD nei paesi della UE non sono armonizzate. Infatti, lo status legale o amministrativo del CBD è responsabilità di ciascuno Stato membro dell’UE. Mentre i medicinali con CBD devono sottostare alla autorizzazione europea dell’EMA tutti gli estratti di Cannabis sativa L. e qualsiasi prodotto a cui sia aggiunto come ingrediente il CBD, ottenuto sinteticamente o meno, dovrebbero essere considerati “nuovi alimenti” (novel food) e sottostare ai controlli e registrazioni dell’EFSA ai sensi del regolamento sui nuovi prodotti alimentari.[86] A tutto il 2020 l’EFSA non ha prodotto un’opinione scientifica sulla sicurezza del cannabidiolo come “nuovo alimento” e a dicembre del 2021 la Commissione europea ha chiuso la procedura di richiesta di autorizzazione.[87]





